Gould e Patel hanno coniato il termine "biloma" nel 1979 per descrivere una raccolta incapsulata di bile extraepatica secondaria alla fuoriuscita di bile nella cavità peritoneale. [1]
Tuttavia, il termine "biloma" si è evoluto per descrivere qualsiasi raccolta di bile intra-addominale ben circoscritta esterna all'albero biliare.
L'interruzione dell'albero biliare può causare la formazione di biloma intraepatico o extraepatico.
L'attuale definizione di biloma non richiede che sia incapsulato, sebbene molti lo siano. [2]
I margini ben circoscritti del biloma lo differenziano dalle perdite biliari in corso o dalla bile libera intraperitoneale. “Choleperitoneum” e “bile ascites” sono altri termini usati per descrivere la bile libera nel peritoneo; tuttavia, parte della letteratura usa questo termine e "biloma" in modo intercambiabile. [3] [4]
Lesioni iatrogene e traumi addominali che causano danni all'albero biliare con conseguente perdita di bile sono le cause più comuni di formazione del biloma. I bilomi sono associati a infezioni, perdite di bile in corso ed effetto di massa sulle strutture circostanti.
Sebbene non comuni, i bilomi sono associati a morbilità e mortalità significative se non diagnosticati tempestivamente e gestiti in modo appropriato. [2]
L'indagine radiologica che utilizza gli ultrasuoni (US), la tomografia computerizzata (TC), la risonanza magnetica (MR), la colangiopancreatografia a risonanza magnetica (MRCP) o la colescintigrafia epatobiliare possono essere utilizzate per formare una diagnosi e consentire la pianificazione di un'accurata gestione minimamente invasiva, ove possibile. [5] [6] [7]
Eziologia
I bilomi sono più comunemente secondari alla rottura dell'albero biliare da una causa iatrogena o traumatica. Le cause iatrogene della formazione del biloma comprendono la colecistectomia laparoscopica, la colangiopancreatografia retrograda endoscopica (ERCP), l'ablazione con radiofrequenza (RFA), la chemioembolizzazione arteriosa transcatetere (TACE), il trapianto di fegato, la resezione e la biopsia. [8] [9] [10] [11] [10] Sebbene estremamente rara, in letteratura è stata riconosciuta la rottura spontanea dell'albero biliare e la formazione del biloma. [12]
Il maggiore utilizzo della colecistectomia laparoscopica negli ultimi 3 decenni è stato collegato a un aumento dei tassi di interruzione dell'albero biliare.
La colecistectomia laparoscopica è associata a lesioni del dotto biliare nello 0,6-1,5% dei casi rispetto allo 0,2-0,3% delle operazioni a cielo aperto. [13]
Le perdite biliari a seguito di colecistectomia laparoscopica possono essere attribuite a danno del dotto biliare comune (CBD), legatura del dotto cistico non riuscita o variazione anatomica che porta a dotti accessori danneggiati o con perdite. [14]
I dotti di Luschka, piccoli dotti drenanti nel sistema biliare, si trovano nella fossa biliare fino al 25-35% dei pazienti e sono vulnerabili ai danni durante la colecistectomia laparoscopica. [15]
La raccolta di liquidi, inclusa la perdita di bile, è più comune dopo la colecistectomia di quanto molti medici credano. Nel 1986, è stato dimostrato che la perdita di bile di piccolo volume si verifica fino al 44% delle colecistectomie laparoscopiche. Tuttavia, il 95% di questi non ha richiesto ulteriore gestione. [16]
Nel 1991, Kang et al. ha mostrato che il 53% dei pazienti sottoposti a ecografia 24 ore dopo la colecistectomia laparoscopica mostrava raccolte di liquidi di piccolo volume.
Tuttavia, hanno stabilito che un'ecografia postoperatoria di routine non cambiava la gestione ed era ingiustificata. [17]
Sebbene sia stato dimostrato che piccole raccolte di liquidi sono comuni dopo l'intervento, queste perdite sono per lo più piccole, asintomatiche e spesso si risolvono senza trattamento.
Si pensa che molte piccole perdite non vengano mai identificate.
Tuttavia, perdite biliari significative e formazione di biloma devono rimanere una diagnosi differenziale chiave nei pazienti con una complicata guarigione dopo colecistectomia laparoscopica. [4]
Il biloma è stato dimostrato in seguito alla perforazione del dotto biliare comune durante ERCP. [18] [19] Uno studio prospettico multicentrico su 5461 pazienti ha mostrato che la perforazione del CBD si è verificata nello 0,4% dei pazienti sottoposti a ERCP.
I fattori di rischio identificati per la perforazione dell'albero biliare includevano l'accesso pretagliato al dotto biliare comune e la presenza di malignità. [19]
La formazione di biloma è stata identificata nel 3,3% di 3284 pazienti sottoposti a RFA di carcinoma epatocellulare.
Tuttavia, la formazione del biloma nel contesto della RFA è una complicazione minore. Chang et al. ha esaminato 109 bilomi dopo RFA per carcinoma epatocellulare, con un solo paziente che necessitava di drenaggio percutaneo del biloma per infezione. [20]
L'ablazione termica del carcinoma epatocellulare è anche associata alla formazione di biloma, con perdite biliari identificate nello 0,1-12% dei casi.
Le precedenti procedure TACE e la ridotta distanza dall'albero biliare erano entrambe associate ad un aumento del rischio di perdita di bile e di formazione di biloma nei pazienti sottoposti ad ablazione termica. [9]
Anche le procedure TACE per il carcinoma epatocellulare sono associate alla formazione di biloma. Zhang et al. ha dimostrato un'incidenza dell'1,04% in 4695 pazienti sottoposti a TACE nel 2017. [21]
È noto che il trapianto di fegato è associato alla formazione di biloma. Il biloma fa parte di uno spettro di colangiopatie post-trapianto. La colangiopatia post-trapianto è una delle complicanze più difficili dopo un trapianto di fegato.
È probabile che la fisiopatologia della colangiopatia post-trapianto comporti danno da ischemia-riperfusione, tossicità da sali biliari o danno immuno-mediato.
La formazione di biloma dopo il trapianto di fegato può essere associata sia a perdite anastomotiche che a stenosi non anastomotiche con necrosi del dotto biliare associato e conseguente perdita di bile intraparenchimale. [11]
La resezione epatica è anche associata alla formazione di biloma a causa dell'interruzione dei dotti biliari intraepatici. [22]
Il trauma addominale è stato associato alla formazione del biloma. Nella maggior parte dei casi, ciò comporta un trauma contusivo alla parte superiore dell'addome.
Il biloma post-traumatico può richiedere da 1 a 2 giorni per comparire. [23] [24]
La rottura spontanea dell'albero biliare è molto rara; tuttavia, è stato associato a debolezze sottostanti nelle pareti dei dotti biliari causate da colelitiasi, colangiocarcinoma, ascesso epatico o infezione da tubercolosi. [25]
La rottura spontanea dell'albero biliare è spesso una diagnosi di esclusione. [26]
La formazione del biloma è anche collegata all'anemia falciforme, con la probabile causa di un infarto epatico. [27]
La perdita di bile può verificarsi senza interrompere l'albero biliare, ad esempio, nella perdita dal moncone duodenale dopo l'intervento chirurgico Billroth II.
Epidemiologia
Ci sono pochi dati epidemiologici per quanto riguarda la formazione del biloma. La maggior parte dei bilomi sono secondari alla rottura iatrogena dell'albero biliare, e quindi l'incidenza dei bilomi dipende dalla frequenza degli interventi. Il biloma si presenta tipicamente in pazienti di età compresa tra 60 e 70 anni.
Ciò probabilmente riflette i fattori eziologici sottostanti che richiedono un intervento invasivo piuttosto che una predisposizione a complicanze con conseguente formazione di biloma. Non è stata mostrata alcuna differenza nell'incidenza della formazione di biloma tra pazienti maschi e femmine. [28]
La formazione spontanea di biloma è estremamente rara, con tutta la letteratura sull'argomento sotto forma di case report. Nel 2007, Ahktar et al. ha osservato che dal 1979 sono stati segnalati 27 casi di biloma spontaneo. [29]
Fisiopatologia
La rottura dell'albero biliare e la conseguente fuoriuscita di bile sono la causa della maggior parte dei bilomi. Si ritiene che l'incapsulamento della perdita di bile avvenga tramite due meccanismi, a seconda del tasso di perdita di bile.
Più comunemente, una lenta fuoriuscita di bile provoca una lieve infiammazione nei tessuti addominali circostanti o nel parenchima epatico, con conseguente fibrosi e incapsulamento.
Gli acidi biliari producono un'infiammazione di basso grado nei tessuti circostanti a causa delle loro proprietà detergenti e di distruzione dei tessuti. [30]
La peritonite biliare può essere presente in grandi volumi, perdite biliari rapide.
Questo può presentarsi con incapsulamento; tuttavia, i pazienti possono presentarsi in modo acuto prima che si sia verificato l'incapsulamento.
Per via intraperitoneale, l'omento e il mesentere possono formare aderenze infiammatorie favorendo l'incapsulamento. [2]
Le dimensioni e la posizione del biloma dipendono dal meccanismo di rottura dell'albero biliare, dal tasso di perdita di bile e dal riassorbimento della bile da parte del parenchima epatico o del peritoneo circostante. [24]
La bile stravasata segue l'anatomia addominale con la sua forma spesso delimitata dal diaframma, dai margini del fegato, dal mesentere e dal mesocolon trasverso. Non è raro che i pazienti abbiano più bilomi.
I bilomi extraepatici si formano prevalentemente nel quadrante superiore destro dell'addome.
Tuttavia, in circa il 40% dei casi, la bile migra attraverso la parte anteriore del fegato verso gli spazi subfrenici sinistro o subepatico sinistro. [2] [29]
Il contenuto del biloma è tipicamente bile giallo-verdastro. Tuttavia, possono contenere sangue o essudato, soprattutto nel contesto dell'infezione.
L'infezione secondaria può portare a una risposta infiammatoria sistemica, sepsi e formazione di ascessi. La storia naturale delle raccolte biliari addominali dai dotti biliari feriti è la progressione dalla raccolta della bile sterile all'infezione. [4]
Storia e fisica
I bilomi si presentano tipicamente con pienezza addominale superiore e fastidio al quadrante superiore destro a seguito di rottura iatrogena o traumatica dell'albero biliare. Nausea, vomito e febbre sono sintomi riconosciuti, soprattutto nei casi di biloma infetto.
L'ittero può essere presente nei casi di compressione estrinseca del dotto biliare.
Gli aspetti chiave richiesti dalla storia includono precedenti interventi chirurgici o endoscopici o traumi addominali che potrebbero aver causato la rottura dell'albero biliare.
Una storia di chirurgia epatobiliare o malattie dell'albero biliare aumenta anche il rischio di perdita di bile e formazione di biloma. [2]
Mentre i pazienti possono presentare un malessere acuto con shock settico da bilomi e molti possono essere asintomatici. La grande variazione nella presentazione dei sintomi rende difficile la diagnosi del biloma.
La peritonite biliare è una presentazione riconosciuta di perdita di bile e grande biloma.
Tuttavia, Lee et al. ha mostrato che questa presentazione è insolita e la maggior parte dei pazienti presenta sintomi più sottili.
Descrivono una diagnosi ritardata nel 77% di 179 pazienti con raccolte di bile addominale e perdite biliari a seguito di colecistectomia laparoscopica. Dolore addominale e dolorabilità significativi sono stati osservati solo nel 21% dei pazienti.
La peritonite iniziale non predice la gravità della malattia, con molti pazienti sottilmente sintomatici che sviluppano gravi complicazioni. [4]
Dopo un intervento iatrogeno o una lesione traumatica, i medici devono prestare attenzione alla distensione addominale persistente, al gonfiore o all'anoressia come segni precoci di perdita di bile e biloma.
I medici devono essere consapevoli che qualsiasi ritardo nel recupero da un intervento chirurgico epatobiliare, in particolare la colecistectomia laparoscopica, è un possibile sintomo precoce di perdita di bile e formazione di biloma.
Il biloma rimane una diagnosi non comune e devono essere prese in considerazione altre diagnosi gastroenterologiche ed epatobiliari per i pazienti che presentano pienezza e disagio addominale superiore.
Tuttavia, nei pazienti che hanno recentemente subito interventi chirurgici o endoscopici nella regione dell'albero biliare, la perdita di bile e il biloma sono diagnosi differenziali essenziali da escludere in quanto possono presentarsi sottilmente e avere morbilità e mortalità significative. [2][4]
Valutazione
I test di laboratorio iniziali possono rivelare una risposta infiammatoria sistemica alla presenza di un biloma. Gli esami del sangue possono dimostrare marcatori infiammatori aumentati come leucocitosi, neutrofilia e proteina C-reattiva aumentata (CRP).
Tuttavia, molti pazienti con biloma non hanno anomalie nei test di laboratorio. Vazquez et al. hanno dimostrato risultati ematici normali nel 40% dei 21 pazienti che si presentano con bilomi. [24]
I test di funzionalità epatica possono essere alterati nei casi di compressione del dotto biliare. Nei casi di biloma infetto, le emocolture possono rivelare batteriemia gram-negativa. Wurstle et al. ha mostrato emocolture positive nel 93% dei 32 bilomi a seguito di danno iatrogeno all'albero biliare.
Gli organismi più comuni trovati in una coltura di laboratorio del fluido del biloma erano le Enterobacteriaceae, seguite dalle specie Enterococcus. Hanno dimostrato batteri multiresistenti nel 25% delle colture di biloma. [31]
La presentazione variabile e spesso sottile dei bilomi fa dell'indagine radiologica il cardine della diagnosi. L'ecografia, la TC, l'imaging RM e l'HIDA sono le principali modalità radiologiche utilizzate nello studio dei bilomi.
L'ecografia dell'addome è spesso la prima indagine a causa della frequenza di presentazione con fastidio al quadrante superiore destro.
L'imaging ecografico può identificare frequentemente una lesione cistica. Può anche mostrare detriti o coaguli di sangue all'interno del biloma.
Gli Stati Uniti possono rivelare un'ampia gamma di risultati da raccolte ben circoscritte nel parenchima epatico a grandi raccolte di liquidi loculati in tutto l'addome. I bilomi fortemente loculati osservati sull'imaging ecografico sono stati associati a un'infezione.
Sebbene l'imaging ecografico sia efficace per identificare una massa cistica, di solito sono necessarie ulteriori immagini per fare una diagnosi.[2] [32]
L'imaging TC mostra tipicamente i bilomi come una raccolta ben circoscritta con margini chiari. Tuttavia, una capsula ben definita non è sempre presente. [2] I bilomi sono in genere raccolte ipoecogene e ipoattenuate che hanno una densità inferiore a 20 unità di Hounsfield alla TC. [24] [33]
L'imaging TC ha il vantaggio di localizzare con precisione il biloma e di visualizzare le strutture circostanti. Sebbene la TC possa fornire un quadro più dettagliato dei bilomi, non può differenziare in modo definitivo tra diagnosi differenziali come sieroma postoperatorio, ematoma, ascesso, linfocele, cisti epatica e pseudocisti. [34] Pertanto, per confermare la diagnosi è spesso necessaria un'ulteriore imaging mediante imaging RM o colescintigrafia epatobiliare insieme a un campionamento diretto del biloma. [2]
L'imaging RM, insieme a MRCP in alcuni casi, può definire ulteriormente le caratteristiche di un biloma. Il biloma produce tipicamente una bassa intensità del segnale sulle immagini pesate in T1 e un'intensità del segnale elevata sulle immagini pesate in T2.
Mentre il contrasto raramente permea il biloma, a volte è presente un miglioramento del bordo a causa dell'infiammazione reattiva. Nelle infezioni sovrapposte si osservano spesso settazioni migliorative. MRCP, in particolare sequenze di lastre sottili, possono dimostrare la fonte di una perdita biliare. [35]
La colescintigrafia epatobiliare è una modalità di imaging non invasiva estremamente efficace nella diagnosi e nella pianificazione del trattamento per i bilomi.
La colescintigrafia utilizza un radiotracciante chiamato acido iminodiacetico Tc-99m e quindi è noto come imaging dell'acido iminodiacetico epatobiliare (HIDA). HIDA è molto sensibile quando cerca una perdita di bile. Tuttavia, non fornisce immagini dettagliate dell'anatomia circostante.
La tomografia computerizzata a emissione di positroni singoli (SPECT) può fornire immagini più dettagliate della posizione di possibili perdite e può essere più utile quando si pianificano drenaggi percutanei guidati da immagini.
Tecniche di imaging invasive come ERCP e colangiogramma transepatico percutaneo (PTC) possono fornire ulteriori indicazioni sulla gestione endoscopica, percutanea o chirurgica. [2] [26]
Talvolta è necessario il campionamento del biloma ecoguidato o TC, seguito da analisi di laboratorio, per confermare la diagnosi quando l'imaging precedente e i risultati clinici non sono conclusivi. [2]
Trattamento/Gestione
La gestione varia a seconda della presentazione clinica, dei risultati di laboratorio e dei risultati radiologici del biloma. Le tre opzioni principali sono il drenaggio percutaneo o endoscopico, il drenaggio chirurgico o il monitoraggio ravvicinato.
La perdita di bile in corso, le dimensioni e la posizione del biloma, insieme all'infezione sovrapposta e alla forma fisica del paziente, determineranno quale strategia di gestione è più appropriata. [2]
Piccole raccolte di liquidi asintomatici possono essere riassorbite e non richiedere alcun intervento. Tuttavia, Lee et al. hanno dimostrato che raccolte di dimensioni superiori a 4 cm venivano raramente riassorbite ed era difficile prevedere se i pazienti sarebbero diventati sintomatici. [4]
La maggior parte dei bilomi può essere gestita con successo con il drenaggio percutaneo radioguidato. La fissazione dell'interruzione sottostante dell'albero biliare non è spesso necessaria. [22] [33]
Il metodo preferito è l'aspirazione ecoguidata o TC guidata da un radiologo interventista. A causa della mancanza di radiazioni e di imaging in tempo reale, nella maggior parte dei casi si preferisce l'ecografia rispetto alla TC. Il doppler spettrale e il colore in tempo reale consentono di evitare le strutture vascolari.
I radiologi interventisti possono accedere ai bilomi extraepatici attraverso il fegato se non c'è un'altra finestra libera.
Altri metodi di drenaggio includono il drenaggio guidato mediante ecografia endoscopica (EUS). Ad esempio, Shami et al. descritto, nel 2008, la gestione di successo dei bilomi adiacenti all'intestino con drenaggio guidato EUS. [36]
Tonozuka et al. ha descritto, nel 2015, la gestione di successo di ascessi epatici e bilomi infetti con stent metallici guidati da EUS. [37]
La maggior parte dei bilomi, senza perdite biliari in corso e gestiti con drenaggio percutaneo, non si ripresentano e hanno una buona prognosi.
Le perdite biliari in corso possono richiedere un'ulteriore gestione, con la fissazione chirurgica o il posizionamento di stent endoscopici.
Tuttavia, Lee et al. raccomandare il drenaggio del biloma post-colecistectomia laparoscopica nel primo caso, soprattutto nel paziente con malattia acuta o sintomatico. [4]
Talvolta sono necessari PTC o drenaggio biliare transepatico percutaneo (PTBD) per visualizzare ulteriormente l'albero biliare o decomprimere la cistifellea quando c'è una perdita di bile in corso. [2]
La gestione chirurgica del biloma è talvolta indicata nel mancato drenaggio percutaneo, in alcune lesioni multiloculate e nei casi con perdite biliari in corso.
I casi di perdita di bile identificati intraoperatoriamente durante la colecistectomia laparoscopica o che richiedono un trattamento chirurgico per la perdita di bile in corso sono gestiti al meglio nei centri terziari specializzati. [38]
La rarità della formazione del biloma significa che ci sono poche prove affidabili oltre i casi clinici e le serie di casi che descrivono le strategie di gestione.
Tuttavia, il drenaggio percutaneo ha gestito con successo il biloma e i pazienti con biloma hanno una prognosi molto buona.
Diagnosi differenziale
Poiché la formazione del biloma è un evento raro, è importante considerare le possibili diagnosi differenziali.
Il disagio del quadrante superiore destro e la pienezza addominale sono sintomi non specifici che hanno un'ampia varietà di possibili cause.
Il biloma dovrebbe entrare nel differenziale in cui i pazienti si presentano in seguito a un evento iatrogeno o traumatico che potrebbe interrompere l'albero biliare.
A seguito di ciò, è necessario eseguire l'imaging appropriato.
La diagnosi differenziale dopo l'indagine radiologica comprende l'ascesso epatico, la cisti, la pseudocisti e il linfocele. Poiché la maggior parte dei bilomi si formano dopo l'intervento o l'indagine post-endoscopica, sieroma ed ematoma sono diagnosi differenziali chiave da considerare.
È importante identificare correttamente i bilomi poiché spesso richiedono drenaggio, mentre molte diagnosi differenziali come l'ematoma non richiedono di routine il drenaggio. [2] [4]
Prognosi
La prognosi del biloma varia a seconda della sede, delle dimensioni e dell'eziologia. Tuttavia, i bilomi non complicati senza perdite biliari in corso sottostanti hanno una buona prognosi. I bilomi piccoli e asintomatici senza perdite biliari in corso sono spesso trattati in modo conservativo con buoni risultati. [2]
Nei pazienti con bilomi sintomatici, il drenaggio tramite radiologia interventistica è una strategia efficace e i pazienti hanno una buona prognosi. [2] [22]
Lee et al. hanno dimostrato che il drenaggio tempestivo dei bilomi sintomatici migliora significativamente la morbilità e la mortalità dei pazienti, riducendo al contempo le possibilità di infezioni e complicanze secondarie. [4]
La maggior parte dei bilomi, essendo stati gestiti con drenaggio percutaneo, non si ripresenteranno e avranno una buona prognosi.
Tuttavia, massicce perdite di bile nel peritoneo sono associate a una morbilità significativa, che spesso richiede un intervento urgente e invasivo per evitare il deterioramento. [4]
Complicazioni
Le complicanze del biloma includono infezioni, shock settico, formazione di ascessi e colestasi per urto sull'albero biliare. Lee et al. descrivono anche pancreatite, insufficienza respiratoria e fistola biliare trans-diaframmatica in pazienti con raccolte biliari addominali. [4]
I rischi del drenaggio percutaneo dei bilomi comprendono sanguinamento, infezione, danni alle strutture circostanti e mancato drenaggio del biloma. Le perdite biliari in corso possono richiedere un'ulteriore gestione endoscopica o chirurgica. [2]
Dissuasione ed educazione del paziente
Sebbene i bilomi si manifestino principalmente a seguito di rottura iatrogena o traumatica dell'albero biliare, i pazienti dovrebbero essere informati in merito ai sintomi e ai segni che possono indicare la formazione di biloma a seguito di un possibile danno traumatico o iatrogeno all'albero biliare.
Sia i pazienti che i medici devono essere consapevoli della possibilità di formazione di biloma in tutti i pazienti che presentano sintomi addominali non specifici a seguito di traumi o procedure che coinvolgono l'albero biliare.
Ciò dovrebbe includere qualsiasi ritardo al recupero previsto a seguito di procedure come la colecistectomia laparoscopica. L'indagine tempestiva e la gestione dei bilomi migliorano la morbilità e la mortalità dei pazienti.
Migliorare i risultati del team sanitario
La rarità della presentazione del biloma significa che ci sono poche prove da ampi studi per guidare la diagnosi e la gestione.
La maggior parte delle prove è sotto forma di serie di casi e rapporti di casi.
Tuttavia, vi è consenso in letteratura sul fatto che i bilomi, se diagnosticati precocemente e gestiti in modo appropriato con drenaggio percutaneo o, in alcuni casi, intervento chirurgico, abbiano una buona prognosi.
Poiché ci sono poche prove per guidare i medici, l'opinione di esperti dovrebbe essere ricercata da chirurghi gastroenterologi, medici e radiologi per intraprendere una diagnosi tempestiva e accurata e una gestione efficace dei bilomi. [Livello 5]
Il team interprofessionale, compresi gli operatori sanitari, infermieristici e perioperatori, dovrebbe essere a conoscenza della formazione di biloma che può derivare da interventi chirurgici o endoscopici epatobiliari.
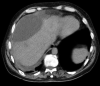
Figura
Immagine TC che mostra il biloma epatico. Contributo di Rian Kabir, MD
This book is distributed under the terms of the Creative Commons Attribution 4.0 International License (http://creativecommons.org/licenses/by/4.0/), which permits use, duplication, adaptation, distribution, and reproduction in any medium or format, as long as you give appropriate credit to the original author(s) and the source, a link is provided to the Creative Commons license, and any changes made are indicated.


